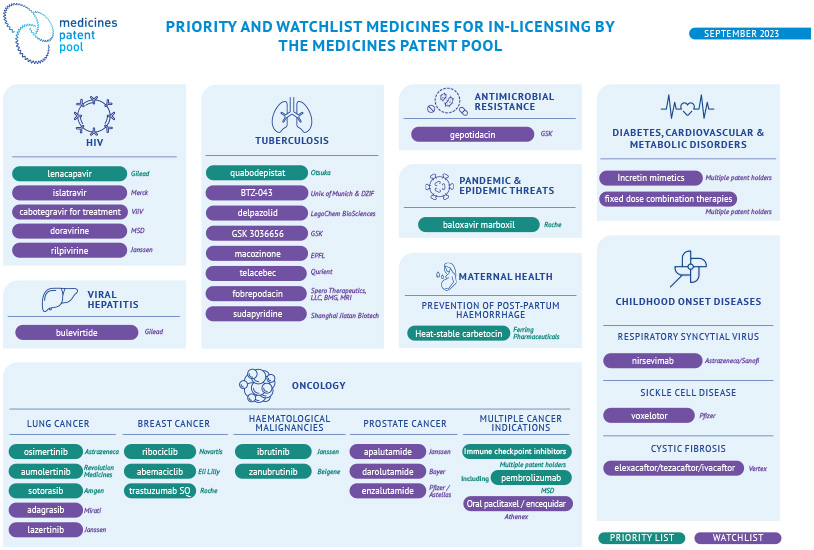
Médicaments prioritaires pour l’obtention de licences par le MPP
En étendant l’accès aux médicaments essentiels, MPP s’engage à soutenir la couverture sanitaire universelle
![]()
L’exercice de priorisation des médicaments et solutions de santé garantit que le MPP concentre ses efforts sur les interventions pour lesquelles un tel modèle pourrait avoir le plus grand impact sur la santé publique.

VIH
RÉSISTANCE AUX ANTIMICROBIENS

HEPATITE VIRALE

TUBERCULOSE

MENACES DE PANDÉMIE ET D'ÉPIDÉMIE
GRIPPE

LE DIABÈTE, LES TROUBLES CARDIOVASCULAIRES ET MÉTABOLIQUES
TROUBLES CARDIOVASCULAIRES ET MÉTABOLIQUES
DIABÈTE

SANTÉ MATERNELLE

MALADIES DE L'ENFANCE
DRÉPANOCYTOSE
VIRUS RESPIRATOIRE SYNCYTIAL

CANCER
CANCER DU SEIN
CANCER DE LA PROSTATE
CANCER DU POUMON
INDICATIONS MULTIPLES POUR LE CANCER
MALIGNITÉS HÉMATOLOGIQUES
Il y a 39 millions de personnes vivant avec le VIH dans le monde, mais seulement 29,8 millions reçoivent actuellement une thérapie antirétrovirale. Les soins pédiatriques liés au VIH s'améliorent, mais seul un enfant sur deux vivant avec le virus a accès à un traitement1. La prévention du VIH est également essentielle pour lutter contre la transmission de la maladie. Bien que la prophylaxie pré-exposition (PrEP) se soit révélée efficace pour prévenir les nouvelles infections par le VIH, son adoption reste lente.
L'accès à des médicaments abordables et efficaces contre le VIH est impératif, en particulier pour les personnes vivant avec le VIH dans les pays à revenu faible et intermédiaire (PRFI) où le VIH est le plus répandu. Les médicaments doivent également être disponibles dans les bonnes formulations. Les combinaisons à dose fixe augmentent l'adhésion au traitement. Des traitements spéciaux pour les enfants, adaptés à leur âge et à leur poids, améliorent les soins.
Depuis 2010, le MPP travaille avec les principaux fabricants de médicaments contre le VIH, les gouvernements, les organisations internationales, la société civile et les communautés touchées2 afin d'améliorer l'accès aux médicaments prioritaires et recommandés par l'Organisation mondiale de la santé pour les personnes vivant avec le VIH dans les PRFM. En 2023, plus de 20 millions de personnes prendront des traitements oraux quotidiens contre le VIH fabriqués par les détenteurs de licences MPP. MPP s'est également efforcé d'améliorer l'accès aux outils de prévention du VIH et de soutenir la diversification des options de prévention. En 2022, le PPM a signé un accord de licence volontaire avec ViiV Healthcare pour le cabotégravir à longue durée d'action (LA) pour la prophylaxie préexposition au VIH (PrEP). Il s'agit d'une étape importante dans l'accélération de l'accès abordable et équitable à la PrEP à longue durée d'action3.
1 ONUSIDA- Fiche d'information : Dernières statistiques sur l'état de l'épidémie de sida (consultée le 21 Sept. 2023)
2 Dans le cadre de son travail avec les communautés, MPP s'appuie sur son Groupe Consultatif Communautaire, un groupe d'experts ayant une expérience vécue qui soutient MPP dans la mise en œuvre de ses activités.
3 MPP travaille en collaboration avec la Coalition pour accélérer l’accès à la PrEP à libération prolongée
Le lénacapavir est une priorité du MPP depuis 2022. Son nouveau mécanisme d'action et ses propriétés à longue durée d'action (jusqu'à 6 mois d'intervalle entre les doses) signifient qu'il pourrait être un produit important dans la prévention et/ou le traitement du VIH (en association avec d'autres médicaments), s'il est prouvé qu'il est sûr et efficace pour ces indications. Les programmes cliniques continuent d'indiquer des profils d'efficacité et de sécurité favorables. En outre, l'OMS a donné la priorité au lenacapavir dans le cadre de ses efforts visant à optimiser les schémas thérapeutiques pour les enfants et les adultes dans le cadre des processus appelés Paediatric Antiretroviral Drug Optimization ( PADO)-5 et Conferences on Antiretroviral Drug Optimization (CADO)- 41.
1 Priorités pour l'optimisation des médicaments antirétroviraux chez les adultes et les enfants - rapport d'une réunion conjointe de CADO, PADO et HIVResNet.
Le cabotégravir à longue durée d'action pour la prophylaxie pré-exposition (PrEP) du VIH a été autorisé par MPP en 2022. Le cabotégravir est le seul inhibiteur du transfert de brin d'intégrase (INSTI) approuvé pour le traitement du VIH à longue durée d'action, en association avec la rilpivirine. Le cabotégravir à longue durée d'action pourrait également devenir un composant d'autres schémas thérapeutiques à longue durée d'action pour le traitement du VIH. Le cabotégravir et la rilpivirine injectables pour le traitement du VIH ne figurent pas actuellement dans les lignes directrices de l'OMS.
La rilpivirine est un inhibiteur non nucléosidique de la transcriptase inverse (INNTI) approuvé pour le traitement de l'infection par le VIH-1. La chaîne du froid est requise pour la rilpivirine injectable à longue durée d'action, qui est disponible en association avec le cabotégravir pour un traitement à longue durée d'action. Le cabotégravir et la rilpivirine injectables à longue durée d'action ne figurent pas actuellement dans les lignes directrices de l'OMS pour le traitement du VIH.
La doravirine est un inhibiteur non nucléosidique de la transcriptase inverse (INNTI) approuvé, indiqué en association avec d'autres agents antirétroviraux pour le traitement de l'infection par le VIH-1. Elle est actuellement étudiée sur le site pour le traitement du VIH en association avec l'islatravir sous forme de traitement oral à prise unique quotidienne et elle a le potentiel d'être un traitement alternatif pour les personnes vivant avec le VIH dans les pays à faible revenu. En outre, une partie de son programme de développement s'est concentrée sur les nourrissons et les enfants. La doravirine ne figure actuellement pas dans les lignes directrices de l'OMS relatives au traitement du VIH.
L'islatravir est le premier médicament d'une nouvelle classe appelée inhibiteurs nucléosidiques de la translocation de la transcriptase inverse (INTRT). Son nouveau mécanisme d'action et ses propriétés de longue durée d'action pourraient en faire un produit important dans le traitement du VIH. Après une période de pause dans le développement clinique de l'islatravir en raison de problèmes de sécurité, Merck a récemment repris certains programmes de développement de l'islatravir tout en surveillant de près sa sécurité. En outre, l'islatravir est l'un des médicaments les plus prometteurs étudiés en association avec le lenacapavir pour un traitement hebdomadaire par voie orale et il est étudié en coformulation avec d'autres médicaments et dans plusieurs plates-formes technologiques à action prolongée.
La résistance aux antimicrobiens (RAM) menace la prévention et le traitement efficaces d'un nombre toujours croissant d'infections causées par des bactéries, des parasites, des virus et des champignons.
La RAM survient lorsque des bactéries, des virus, des champignons et des parasites évoluent au fil du temps et ne répondent plus aux médicaments, ce qui rend les infections plus difficiles à traiter et augmente le risque de propagation de la maladie, de maladie grave et de décès. En conséquence, les médicaments deviennent inefficaces et les infections persistent dans le corps, augmentant le risque de propagation à d'autres personnes.
Les antimicrobiens - y compris les antibiotiques, les antiviraux, les antifongiques et les antiparasitaires - sont des médicaments utilisés pour prévenir et traiter les infections chez les humains, les animaux et les plantes. Les micro-organismes qui développent une résistance aux antimicrobiens sont parfois appelés "superbactéries".
L'engagement du MPP à identifier de nouveaux médicaments prometteurs pour les maladies infectieuses causées par des agents pathogènes qui ont développé une résistance aux thérapies disponibles est équilibré par des efforts de gestion visant à éviter le développement d'une résistance aux nouveaux antimicrobiens. Il s'agit d'un domaine dans lequel le MPP a déjà entrepris des travaux dans le cadre de ses activités relatives à la tuberculose, et il continuera à soutenir les efforts en cours pour lutter contre la résistance aux antimicrobiens.
La gépotidacine est un antibiotique oral expérimental, premier de sa classe, destiné au traitement des infections urinaires non compliquées et de la gonorrhée urogénitale non compliquée (UUG). La gépotidacine est active contre la plupart des souches d'uropathogènes cibles, telles que E.coli et Staphylococcus saprophyticus, y compris les isolats résistants aux antibiotiques actuels. De plus, en raison du mécanisme d'action de la gépotidacine, qui bloque la réplication de l'ADN bactérien en inhibant deux enzymes vitales, des mutations dans ces deux enzymes sont nécessaires pour affecter de manière significative la sensibilité à la gépotidacine. Cela permet d'espérer que ce médicament restera efficace car il sera plus difficile de développer une résistance.
354 millions de personnes dans le monde vivent avec une hépatite B ou C1. L'hépatite provoque des lésions du foie et des cancers. Elle tue plus d'un million de personnes par an. Parmi les cinq types d'hépatites, les hépatites B et C sont à l'origine de la plupart des maladies et des décès. L'hépatite C peut être guérie ; cependant, seulement 21% des personnes vivant avec l'hépatite C sont diagnostiquées et seulement 13% ont reçu un traitement curatif. Le MPP travaille avec un large éventail de partenaires, dont les fabricants de médicaments originaux et génériques, les gouvernements, l'OMS, la société civile et les communautés2, les agences d'approvisionnement et d'autres, afin d'étendre et d'accélérer le développement et la distribution de ces nouveaux traitements qui peuvent éliminer le virus grâce à une thérapie orale de courte durée dans les pays à faible et moyen revenu où la charge du VHC est élevée.
Hépatite C
L'hépatite C est une maladie du foie causée par le virus de l'hépatite C (VHC). On estime que parmi les 58 millions de personnes vivant avec le virus de l'hépatite C, 62% d'entre elles résident dans des pays à revenu faible ou intermédiaire3. Les nouveaux antiviraux à action directe (AAD) qui sont efficaces sur tous les principaux génotypes du VHC peuvent guérir plus de 95 % des personnes traitées, généralement en 3 mois ou moins. Pourtant, environ 84 % des personnes infectées par le VHC ne reçoivent pas de traitement4. La communauté de brevets sur les médicaments travaille avec des partenaires génériques pour accélérer le développement et la distribution de ces nouveaux traitements qui peuvent éliminer le virus par une thérapie orale de courte durée dans les régions où la charge de morbidité du VHC est élevée. Le MPP a signé des accords de licence pour trois traitements de l'hépatite C : le daclatasvir (DAC) en 2015, le ravidasvir (RAV) en 2017 et le glecaprevir/pibrentasvir (G/P) en 2018. En outre, une formulation injectable à longue durée d'action de G/P est développée par l'Université de Liverpool avec un financement d'Unitaid, et a été concédée sous licence à MPP.
Hépatite B
L'hépatite B chronique est une maladie qui touche 296 millions de personnes dans le monde4. Environ 60 % des personnes atteintes d'hépatite B vivent dans les pays à faible revenu. Les licences accordées par Gilead Sciences à MPP, qui couvrent le fumarate de ténofovir disoproxil (TDF) et l'alafénamide de ténofovir (TAF), profitent aux personnes vivant avec le VIH ainsi qu'aux personnes vivant avec l'hépatite B chronique.
1 Organisation mondiale de la santé - Élimination de l'hépatite d'ici à 2030
2 Dans le cadre de son travail avec les communautés, MPP s'appuie sur son groupe consultatif communautaire, un groupe d'experts ayant une expérience vécue qui soutient MPP dans la mise en œuvre de ses activités.
3 Organisation mondiale de la santé - Fiche d'information - Politiques relatives à l'hépatite virale B et C dans les pays et charge de morbidité dans les régions de l'OMS, 2023
4 Organisation mondiale de la santé - Rapport mondial sur le VIH, l'hépatite virale et les infections sexuellement transmissibles, 2021
Le bulevirtide a récemment été approuvé sous conditions par l'EMA et est aujourd'hui le seul traitement spécifique de l'hépatite delta. La durée du traitement et la nécessité d'une injection sous-cutanée quotidienne peuvent présenter certains défis dans les PRFM. En outre, sa sécurité et son efficacité sont encore en cours d'évaluation et le bulevirtide a donc été inclus dans la liste de surveillance.
On estime à 10,6 millions le nombre de personnes atteintes de tuberculose dans le monde en 2021, la plupart d'entre elles se trouvant dans des pays à revenu faible ou intermédiaire. La tuberculose est la principale cause de décès chez les personnes séropositives et contribue largement à la résistance aux antimicrobiens. En 2021, 1,6 million de personnes mourront de la tuberculose, dont 187 000 personnes séropositives. On estime à 450 000 le nombre de cas de tuberculose multirésistante ou résistante à la rifampicine (TB-MR/RR) dans le monde en 2021.
La stratégie mondiale de lutte contre la tuberculose de l'Organisation mondiale de la santé pour l'après-20151 de l'Organisation mondiale de la santé fixe des objectifs ambitieux visant à réduire de 95 % le nombre de décès dus à la tuberculose entre 2015 et 2035, et à mettre fin à la tuberculose. Pour atteindre ces objectifs, il est urgent de disposer de meilleures thérapies pour traiter la tuberculose, en particulier la tuberculose multirésistante. Depuis 2020, le projet PAN-TB (Project to Accelerate New Treatments for Tuberculosis) vise à développer de nouveaux schémas thérapeutiques afin de transformer les soins prodigués aux patients atteints de tuberculose.
Nous nous efforçons d'améliorer l'accès aux nouveaux traitements de la tuberculose multirésistante et de la tuberculose sensible aux médicaments. Nous facilitons également le développement de nouveaux schémas thérapeutiques en octroyant des licences pour des médicaments antituberculeux qui sont encore en cours de développement. Début 2017, MPP a signé son premier accord avec l'université Johns Hopkins. Cet accord visait à faciliter le développement clinique du sutezolid, un traitement expérimental prometteur contre la tuberculose. Il a été suivi d'un deuxième accord avec Pfizer en octobre 2019 pour accéder aux données et résultats des études précliniques, de phase I et de phase IIa de Pfizer sur le sutezolide. L'objectif de cet accord était de poursuivre l'étude, le développement et la mise à disposition de ce composant potentiel important des nouveaux traitements antituberculeux.
1 Organisation mondiale de la santé - Rapport mondial sur la tuberculose 2022 (dernier accès le 25 sept. 2023).
Le quabodepistat (OPC-167832) est une molécule dotée d'un nouveau mécanisme d'action qui présente une puissante activité antituberculeuse et un profil de sécurité favorable. Elle est actuellement étudiée dans le cadre d'un nouveau traitement prometteur contre la tuberculose dans le cadre du programme PAN-TB (Project to Accelerate New Treatments for Tuberculosis), en association avec le delamanid, la bédaquiline et le sutezolide (DBOS) ou en association avec le pretomanid, la bédaquiline et le sutezolide (PBOS).
Le BTZ-043 est un agent expérimental, actif contre toutes les souches de Mycobacterium tuberculosis testées, y compris les isolats cliniques de patients MDR et XDR. Les données cliniques sur le BTZ-043 sont encore immatures et le médicament candidat reste donc sur la liste de surveillance.
Le delpazolide est un agent antituberculeux expérimental. Il est étudié en association avec le delamanid et la bédaquiline. Les données cliniques étant encore immatures, ce médicament candidat reste sous surveillance.
Le ganfeborole (GSK3036656) est un agent expérimental qui a démontré une activité bactéricide précoce avec une faible dose orale en une prise par jour après 14 jours de traitement chez des participants atteints de tuberculose pulmonaire sensible aux médicaments. Les données cliniques sur le GSK3036656 sont encore immatures et le médicament candidat reste donc dans la liste de surveillance.
Macozinone (PBTZ-169) est un candidat-médicament contre la tuberculose qui a démontré une grande puissance contre Mycobacterium tuberculosis sensible et résistant aux médicaments dans des études précliniques. La macozinone a des effets additifs avec de nombreux agents thérapeutiques contre la tuberculose, commercialisés ou en cours de développement, et a des effets synergiques avec la bédaquiline et la clofazimine dans les modèles précliniques. Les données cliniques sur la macozinone sont encore immatures.
Telacebec (Q203) est une petite molécule candidate active par voie orale, la première de sa catégorie, qui bloque la croissance de Mycobacterium tuberculosis. L'efficacité puissante de Telacebec contre la tuberculose sensible et résistante aux médicaments a été démontrée dans des études précliniques et cliniques. Telacebec a reçu la désignation de médicament orphelin et la désignation de procédure accélérée de la part de la FDA américaine. Récemment, Qurient et TB Alliance ont annoncé un accord de licence exclusive pour ce candidat. Les données cliniques sur Telacebec sont encore immatures et le médicament candidat reste donc sur la liste de surveillance.
La fobrepodacine (SPR720) est étudiée en tant que thérapie orale pour le traitement des infections à mycobactéries non tuberculeuses (MNT). Les agents pathogènes responsables des maladies pulmonaires à mycobactéries non tuberculeuses sont des agents pathogènes environnementaux omniprésents qui peuvent provoquer des lésions pulmonaires progressives et une insuffisance respiratoire, en particulier chez les patients dont le système immunitaire est affaibli ou qui souffrent de troubles pulmonaires sous-jacents. Les MNT constituent un problème de santé mondial croissant et un besoin médical majeur non satisfait en raison du manque de nouveaux médicaments développés pour lutter contre ces bactéries. Les données cliniques sur la fobrepodacine ne sont pas encore mûres et le médicament candidat est donc inscrit sur la liste de surveillance.
La sudapyridine (WX-081) est un analogue de la bédaquiline qui présente une activité antimycobactérienne et une faible toxicité. Les données cliniques sur la sudapyridine n'étant pas encore mûres, le médicament candidat est inscrit sur la liste de surveillance.
Menaces pandémiques et épidémiques
Les épidémies sont une augmentation inattendue, souvent soudaine, d'une maladie spécifique au sein d'une communauté ou d'une région. On parle de pandémie lorsqu'une épidémie survient dans le monde entier, franchissant les frontières internationales et touchant un grand nombre de personnes. Un certain nombre de maladies transmissibles peuvent constituer des menaces sanitaires importantes aux niveaux local, régional et mondial et entraîner des épidémies ou des pandémies. Les épidémies et les pandémies peuvent être évitées et atténuées par une série de mesures, telles qu'une bonne hygiène, une distanciation sociale, des médicaments et la vaccination.
Les pandémies constituent une menace importante pour la sécurité sanitaire mondiale. En s'engageant activement dans la préparation aux pandémies, MPP contribue à la résilience des systèmes de santé et aide à atténuer l'impact des futures crises sanitaires. Le MPP travaille avec des innovateurs et des sociétés pharmaceutiques pour accélérer le développement et la fabrication de contre-mesures médicales.
En facilitant l'octroi de licences de propriété intellectuelle et le transfert de technologies, le MPP peut soutenir la production de ces outils vitaux dans les PRFM et contribuer à garantir que les produits liés à la pandémie sont accessibles aux gouvernements et aux systèmes de soins de santé, en particulier dans les pays à revenu faible et intermédiaire, de manière équitable.
Grippe saisonnière
La grippe saisonnière est une infection respiratoire aiguë causée par des virus grippaux qui circulent dans toutes les régions du monde. Elle représente une charge de morbidité tout au long de l'année. Elle provoque des maladies plus ou moins graves qui entraînent parfois l'hospitalisation et la mort.
Au niveau mondial, on estime que les épidémies de grippe provoquent chaque année entre 3 et 5 millions de cas de maladie grave et entre 290 000 et 650 000 décès dus à des troubles respiratoires.
Compte tenu de son impact potentiel sur les éventuelles pandémies de grippe, MPP a ajouté le baloxavir marboxil comme produit prioritaire pour l'octroi de licences.
GRIPPE
Le baloxavir marboxil, un traitement oral unique contre la grippe, pourrait servir, en plus de son utilisation contre la grippe saisonnière, d'outil précieux pour la préparation à la pandémie en cas d'apparition d'une nouvelle souche grippale très virulente. En tant que médicament d'une nouvelle classe de traitements antiviraux contre la grippe, il pourrait fournir une couche supplémentaire de défense et une option contre les virus résistants aux antiviraux existants.
Le cancer est l'une des principales causes de décès dans le monde. Il sera à l'origine de près de 10 millions de décès en 2020, soit près d'un décès sur six1. Parmi les types de cancer les plus répandus, les cancers du sein, du poumon, du côlon et du rectum, de la prostate, de l'estomac, du foie, du col de l'utérus et de la peau sont les plus fréquents. De nombreux cancers peuvent être guéris s'ils sont détectés tôt et traités efficacement. De nombreux systèmes de santé dans les pays à faibles et moyens revenus restent mal équipés pour faire face à cette crise sanitaire croissante. Par conséquent, une grande partie des patients atteints de cancer dans le monde continue de se heurter à des obstacles importants qui les empêchent d'accéder à un diagnostic et à un traitement de qualité en temps voulu.
Cancer du poumon
Le cancer du poumon résulte de la prolifération rapide et non régulée de cellules anormales dans les poumons, ce qui représente une menace importante pour la santé et un risque élevé de décès. Les deux formes les plus courantes de cancer du poumon sont : le carcinome pulmonaire non à petites cellules (CPNPC), qui est répandu et tend à se développer progressivement, et le carcinome pulmonaire à petites cellules (CPPC), qui est plus rare mais présente généralement un taux de croissance rapide. Dans les pays à revenu faible et intermédiaire (PRFI), on a recensé 1,2 million de cas incidents de cancer du poumon non à petites cellules (CPNPC) en 20202. Malheureusement, environ 70 % des cas de CPNPC sont diagnostiqués à un stade avancé, c'est-à-dire à un stade localement avancé ou métastatique.
Cancer du sein
Le cancer du sein est le cancer le plus fréquent chez les femmes et le cancer le plus fréquent en général. En 2020, plus de 2,26 millions de nouveaux cas de cancer du sein ont été recensés chez les femmes3. Il existe quatre sous-types principaux de cancer du sein chez la femme, dont les suivants par ordre de prévalence : HR+/HER2-, HR-/HER2-, HR+/HER2+, HR-/HER2+. HR signifie récepteur hormonal. HR+ signifie que les cellules tumorales possèdent des récepteurs pour les hormones œstrogènes ou progestérone, ce qui peut favoriser la croissance des tumeurs HR+. HER2 signifie récepteur 2 du facteur de croissance épidermique humain. HER2+ signifie que les cellules tumorales produisent des niveaux élevés d'une protéine appelée HER2/neu, qui s'est avérée être associée à certains types agressifs de cancer du sein4.
Leucémie lymphoïde chronique
La leucémie lymphoïde chronique (LLC) est la forme la plus courante de leucémie, représentant 25 à 30 % de tous les cas de leucémie dans les pays occidentaux5. En 2019, la LLC a entraîné 44 612 décès dans le monde. En ce qui concerne les taux d'incidence en 2019, la LLC a touché 1,34 personnes pour 100 000 dans la population mondiale, avec des taux de 1,13 dans les pays à revenu élevé, 0,45 dans les pays à revenu intermédiaire et 0,28 dans les pays à faible revenu6. La LLC touche principalement les personnes âgées, avec un pic dans la population âgée, l'âge médian au moment du diagnostic étant de 71 ans en Europe7. En outre, l'incidence de la LLC est environ deux fois plus élevée chez les hommes que chez les femmes8.
Cancer de la prostate
Le cancer de la prostate représentait 7,3 % de tous les nouveaux cas de cancer en 2020, soit 14,1 % de tous les nouveaux diagnostics de cancer chez l'homme9. Les taux d'incidence du cancer sont notamment en hausse dans diverses populations d'Afrique subsaharienne10. Les hommes d'origine africaine courent un risque presque deux fois plus élevé d'être diagnostiqués avec un cancer de la prostate avant l'âge de 45 ans que les hommes caucasiens11. En outre, la recherche indique que les hommes ayant une masse graisseuse globale et centrale plus importante présentent un risque accru de mortalité liée au cancer de la prostate12.
1 Organisation mondiale de la santé - Fiche d'information sur le cancer (dernière consultation le 25 septembre 2023).
2 Centre international de recherche sur le cancer - Cancer Today (dernier accès : 25 septembre 2023).
3 Centre international de recherche sur le cancer - Cancer Today (dernier accès : 25 septembre 2023).
4 NIH - National Cancer Institute (dernier accès le 25 sept. 2023).
5 La charge mondiale et les facteurs de risque attribuables à la leucémie lymphoïde chronique dans 204 pays et territoires de 1990 à 2019 : analyse basée sur l'étude de la charge mondiale de morbidité 2019. Biomed Eng Online. 2022.
6 Institute for Health Metrics and Evaluation - Étude sur la charge mondiale de morbidité 2019.
7 Prise en charge de la leucémie lymphoïde chronique (LLC) chez les personnes âgées : un document de synthèse d'un groupe de travail de la Société internationale d'oncologie gériatrique (SIOG). Annals of Oncology. 2017.
8 Sex differences in incidence and outcome of chronic lymphocytic leukemia patients. Leukemia & Lymphoma. 2006.
9 Centre international de recherche sur le cancer - Cancer Today (dernier accès : 25 septembre 2023).
10 Augmentation de l'incidence du cancer de la prostate en Afrique subsaharienne : A Trend Analysis of Data from the African Cancer Registry Network. Cancer Epidemiol Biomarkers Prev. 2021.
11 Pathways to diagnosis for Black men and White men found to have prostate cancer : the PROCESS cohort study (Parcours vers le diagnostic pour les hommes noirs et les hommes blancs atteints d'un cancer de la prostate : l'étude de cohorte PROCESS). Br J Cancer. 2008.
12 Adiposité et risque de décès par cancer de la prostate : analyse prospective de la UK Biobank et méta-analyse des études publiées. BMC Med. 2022.
CANCER DU SEIN
Les inhibiteurs du point de contrôle immunitaire (ICI) sont des anticorps monoclonaux utilisés pour l'immunothérapie dans le domaine de l'oncologie. Les ICIs bloquent les protéines qui empêchent le système immunitaire d'attaquer les cellules cancéreuses. Les représentants les plus connus de cette classe sont les inhibiteurs de PD-1 et les inhibiteurs de PD-L1. Les ICIs ont été approuvés pour traiter une variété de cancers et de nombreux ICIs sont en cours de développement. Le comité de la liste des médicaments essentiels (LME) de l'OMS a reconnu leur importance en tant que classe thérapeutique. Certains d'entre eux figurent sur la LME pour le traitement du mélanome cutané. Dans plusieurs cas, le comité de la LME de l'OMS a recommandé de continuer à travailler sur des stratégies visant à rendre ces médicaments plus abordables et a également suggéré que certains d'entre eux soient pris en considération pour l'octroi d'une licence par le MPP. En outre, le soutien au transfert de technologie du MPP pourrait contribuer à une mise en œuvre réussie en réduisant le temps de développement et les coûts des versions biosimilaires pour une utilisation dans les PRFM. Le MPP a donné la priorité aux ICI en tant que classe, et des molécules spécifiques, telles que le pembrolizumab, sont énumérées ici à titre d'exemples de cet effort.
La formulation intraveineuse du paclitaxel a été ajoutée à la LME en 2011 et utilisée dans les protocoles de traitement de nombreux cancers. En attendant la confirmation de sa sécurité et de son efficacité, ce nouveau mode d'administration par voie orale, actuellement en cours de développement, pourrait être particulièrement prometteur pour les pays à faible revenu, et a donc été inclus dans la liste de surveillance.
Ribociclib est un inhibiteur oral des kinases 4 et 6 dépendantes de la cycline (CDK 4/6), approuvé par la Food and Drug Administration pour le traitement du cancer du sein avancé HR+/HER2-. Le comité d'experts de la liste des médicaments essentiels a reconnu son potentiel d'inclusion future et a recommandé à MPP d'explorer les possibilités d'octroi de licences.
Abemaciclib est un inhibiteur oral des kinases 4 et 6 dépendantes de la cycline (CDK 4/6), approuvé par la Food and Drug Administration pour le traitement du cancer du sein avancé HR+/HER2-, recommandé comme option préférentielle dans le traitement du cancer du sein avancé. Les inhibiteurs de CDK 4/6 sont l'option préférentielle recommandée dans le traitement du cancer du sein avancé. Le comité d'experts de la liste des médicaments essentiels a reconnu son potentiel d'inclusion future et a recommandé à MPP d'explorer les possibilités d'octroi de licences. L'abemaciclib présente un profil de sécurité similaire à celui du ribociclib, mais avec un schéma posologique différent, ce qui en fait une alternative intéressante.
Le trastuzumab sous-cutané est un anticorps monoclonal approuvé par la FDA en 2019 pour le traitement du cancer du sein surexprimant HER2+. Il s'agit du même anticorps monoclonal que le trastuzumab intraveineux avec l'avantage d'être plus facile et plus rapide à administrer.
CANCER DE LA PROSTATE
L'apalutamide est un antagoniste des récepteurs androgéniques de seconde génération approuvé par la Food and Drug Association en 2018. En tant que classe de médicaments, les antagonistes des récepteurs androgéniques de seconde génération améliorent la survie globale des patients atteints de cancer de la prostate. L'apalutamide est un candidat alternatif potentiel solide.
Le darolutamide est un antagoniste des récepteurs androgéniques de la seconde génération approuvé par la Food and Drug Association en 2019. En tant que classe de médicaments, les antagonistes des récepteurs androgéniques de seconde génération améliorent la survie globale des patients atteints de cancer de la prostate. Le darolutamide est un candidat alternatif potentiel solide.
La formulation intraveineuse du paclitaxel a été ajoutée à la LME en 2011 et utilisée dans les protocoles de traitement de nombreux cancers. En attendant la confirmation de sa sécurité et de son efficacité, ce nouveau mode d'administration par voie orale, actuellement en cours de développement, pourrait être particulièrement prometteur pour les pays à faible revenu, et a donc été inclus dans la liste de surveillance.
CANCER DU POUMON
Les inhibiteurs du point de contrôle immunitaire (ICI) sont des anticorps monoclonaux utilisés pour l'immunothérapie dans le domaine de l'oncologie. Les ICIs bloquent les protéines qui empêchent le système immunitaire d'attaquer les cellules cancéreuses. Les représentants les plus connus de cette classe sont les inhibiteurs de PD-1 et les inhibiteurs de PD-L1. Les ICIs ont été approuvés pour traiter une variété de cancers et de nombreux ICIs sont en cours de développement. Le comité de la liste des médicaments essentiels (LME) de l'OMS a reconnu leur importance en tant que classe thérapeutique. Certains d'entre eux figurent sur la LME pour le traitement du mélanome cutané. Dans plusieurs cas, le comité de la LME de l'OMS a recommandé de continuer à travailler sur des stratégies visant à rendre ces médicaments plus abordables et a également suggéré que certains d'entre eux soient pris en considération pour l'octroi d'une licence par le MPP. En outre, le soutien au transfert de technologie du MPP pourrait contribuer à une mise en œuvre réussie en réduisant le temps de développement et les coûts des versions biosimilaires pour une utilisation dans les PRFM. Le MPP a donné la priorité aux ICI en tant que classe, et des molécules spécifiques, telles que le pembrolizumab, sont énumérées ici à titre d'exemples de cet effort.
Le pembrolizumab est l'un des inhibiteurs de points de contrôle immunitaires dont le MPP a fait sa priorité. En monothérapie, le pembrolizumab réduit de 40 % le risque de décès chez les patients atteints de cancer du poumon non à petites cellules et prolonge la survie de plus d'un an avec moins d'effets secondaires que la chimiothérapie traditionnelle. Le pembrolizumab est également indiqué contre plusieurs autres cancers.
L'osimertinib est un inhibiteur de tyrosine kinase du récepteur du facteur de croissance épidermique (EGFR TKI) de 3e génération approuvé par la Food and Drug Association et l'Agence européenne des médicaments . Il a démontré des avantages significatifs par rapport aux traitements de première ligne standard de première et deuxième générations figurant sur la liste des médicaments essentiels (LME) de l'OMS pour le traitement du cancer du poumon non à petites cellules . Le comité de la LME a demandé à MPP d'explorer les possibilités d'octroi de licences pour l'osimertinib.
L'aumolertinib est un inhibiteur de tyrosine kinase du récepteur du facteur de croissance épidermique (EGFR TKI) de troisième génération, qui a démontré des avantages significatifs par rapport aux traitements de première ligne standard de première et deuxième générations figurant sur la liste des médicaments essentiels de l'OMS pour le traitement du cancer du poumon non à petites cellules. L'Aumolertinib est en cours d'examen par l'Agence européenne des médicaments (EMA).
La formulation intraveineuse du paclitaxel a été ajoutée à la LME en 2011 et utilisée dans les protocoles de traitement de nombreux cancers. En attendant la confirmation de sa sécurité et de son efficacité, ce nouveau mode d'administration par voie orale, actuellement en cours de développement, pourrait être particulièrement prometteur pour les pays à faible revenu, et a donc été inclus dans la liste de surveillance.
L'adagrasib est un inhibiteur du virus du sarcome du rat de Kirsten (KRAS) administré par voie orale, qui a été approuvé par la Food and Drug Administration (FDA) pour le traitement du cancer du poumon non à petites cellules (CPNPC) en 2022 et qui présente des avantages cliniques durables pour les patients.
Le lazertinib est un inhibiteur de tyrosine kinase du récepteur du facteur de croissance épidermique (EGFR TKI) expérimental de troisième génération , qui présente une supériorité par rapport à la première génération d'EGFR TKI. Le lazertinib a un fort potentiel en tant qu'option alternative pour le traitement du cancer du poumon.
Le sotorasib est un inhibiteur du virus du sarcome du rat de Kirsten (KRAS) administré par voie orale, qui a reçu une autorisation accélérée de la Food and Drug Administration (FDA) pour le traitement du cancer du poumon non à petites cellules (CPNPC) en 2021. Une étude récente a montré que le sotorasib offrait des avantages significatifs par rapport au traitement intraveineux standard.
INDICATIONS MULTIPLES POUR LE CANCER
Les inhibiteurs du point de contrôle immunitaire (ICI) sont des anticorps monoclonaux utilisés pour l'immunothérapie dans le domaine de l'oncologie. Les ICIs bloquent les protéines qui empêchent le système immunitaire d'attaquer les cellules cancéreuses. Les représentants les plus connus de cette classe sont les inhibiteurs de PD-1 et les inhibiteurs de PD-L1. Les ICIs ont été approuvés pour traiter une variété de cancers et de nombreux ICIs sont en cours de développement. Le comité de la liste des médicaments essentiels (LME) de l'OMS a reconnu leur importance en tant que classe thérapeutique. Certains d'entre eux figurent sur la LME pour le traitement du mélanome cutané. Dans plusieurs cas, le comité de la LME de l'OMS a recommandé de continuer à travailler sur des stratégies visant à rendre ces médicaments plus abordables et a également suggéré que certains d'entre eux soient pris en considération pour l'octroi d'une licence par le MPP. En outre, le soutien au transfert de technologie du MPP pourrait contribuer à une mise en œuvre réussie en réduisant le temps de développement et les coûts des versions biosimilaires pour une utilisation dans les PRFM. Le MPP a donné la priorité aux ICI en tant que classe, et des molécules spécifiques, telles que le pembrolizumab, sont énumérées ici à titre d'exemples de cet effort.
La formulation intraveineuse du paclitaxel a été ajoutée à la LME en 2011 et utilisée dans les protocoles de traitement de nombreux cancers. En attendant la confirmation de sa sécurité et de son efficacité, ce nouveau mode d'administration par voie orale, actuellement en cours de développement, pourrait être particulièrement prometteur pour les pays à faible revenu, et a donc été inclus dans la liste de surveillance.
MALIGNITÉS HÉMATOLOGIQUES
L'ibrutinib est un inhibiteur de la tyrosine kinase de Bruton (BTKi) approuvé par la Food and Drug Administration en 2013 et ajouté à la liste complémentaire de la liste des médicaments essentiels pour le traitement de la leucémie lymphoïde chronique (LLC). L'ibrutinib a démontré des avantages majeurs par rapport à la chimio-immunothérapie. Le comité d'experts de la liste des médicaments essentiels a recommandé à MPP d'explorer les possibilités d'octroi de licences.
Le zanubrutinib est un inhibiteur de la tyrosine kinase de Bruton (BTKi) approuvé par la FDA en 2023 pour le traitement de la leucémie lymphoïde chronique (LLC). Reconnaissant l'importance du rôle émergent des BTKi en tant que classe thérapeutique dans le traitement de la LLC, le comité du LME a indiqué qu'il considérerait une demande de zanubrutinib comme une alternative thérapeutique à inclure et a recommandé à MPP d'explorer cette possibilité d'octroi de licence.
Diabète
Actuellement, 537 millions d'adultes (10,5 % de la population mondiale) sont aux prises avec le diabète. Les projections indiquent que ce nombre atteindra 643 millions d'ici à 20301. Environ 240 millions de personnes dans le monde vivent avec un diabète non diagnostiqué, ce qui signifie que près d'un adulte sur deux n'est pas conscient de sa maladie. Notamment, 90 % de ces cas non diagnostiqués sont concentrés dans les pays à revenu faible et intermédiaire (PRFI). Le diabète de type 1 touche plus de 1,2 million d'enfants et d'adolescents, dont 54 % ont moins de 15 ans. Le diabète de type 2 est le type de diabète le plus courant, représentant plus de 90 % de l'ensemble des diabètes dans le monde. La prévalence du diabète de type 2 est élevée et en augmentation dans toutes les régions. Elle est également devenue préoccupante chez les enfants et les jeunes en raison de l'augmentation de la prévalence de l'obésité.
Maladies cardiovaculaires
Les maladies cardiovasculaires (MCV) sont la première cause de mortalité dans le monde, représentant 32 % de tous les décès en 2019, avec environ 17,9 millions de vies perdues. Plus des trois quarts des décès dus aux MCV surviennent dans les pays à revenu faible ou intermédiaire. Ces maladies étaient responsables de 38 % des 17 millions de décès prématurés (personnes âgées de moins de 70 ans) attribués aux maladies non transmissibles en 2019. La détection précoce des maladies cardiovasculaires est essentielle pour mettre en place une prise en charge opportune par le biais de conseils et de médicaments2. Malgré des preuves scientifiques de grande qualité sur les avantages des différentes classes de médicaments dans la prévention et le contrôle des maladies cardiovasculaires, leur utilisation actuelle reste faible.
1 Fédération internationale du diabète - Atlas du diabète 2021 (dernier accès le 25 septembre 2023).
2 Organisation mondiale de la santé - Fiche d'information sur les maladies cardiovasculaires.
TROUBLES CARDIOVASCULAIRES ET MÉTABOLIQUES
Il a été démontré que les associations cardiovasculaires à dose fixe de plusieurs médicaments (communément appelées "polypills") permettent de rationaliser les schémas thérapeutiques, d'améliorer l'observance et de mieux contrôler les facteurs de risque. Les polyprimés pour la prévention des maladies cardiovasculaires sont composés d'agents hypocholestérolémiants, d'un ou plusieurs agents hypotenseurs et, si nécessaire, d'acide acétylsalicylique (aspirine). Leur inclusion récente dans la LME devrait améliorer l'accessibilité et le caractère abordable de ces médicaments essentiels, qui ont le potentiel de sauver des millions de vies chaque année.
Les hormones incrétines sont des hormones intestinales qui amplifient la sécrétion d'insuline induite par les nutriments en réponse à la prise de repas. Les peptides incrétines, principalement le Glucagon-like Peptide-1 (GLP-1) et le Gastric inhibitory polypeptide (GIP), régulent la sécrétion des hormones des îlots de Langerhans, les concentrations de glucose, le métabolisme des lipides, la motilité intestinale, l'appétit et le poids corporel, ainsi que la fonction immunitaire, fournissant une base scientifique pour l'utilisation de thérapies basées sur les incrétines dans le traitement du diabète de type 2 1. Les agonistes des récepteurs du peptide-1 de type glucagon (GLP-1 RA) sont des options intéressantes pour le traitement du DT2 car ils réduisent efficacement la glycémie et le poids tout en présentant un faible risque d'hypoglycémie. Certains AR GLP-1 ont également des effets bénéfiques documentés sur le système cardiovasculaire, la maladie rénale chronique et la stéatose hépatique non alcoolique.
1 Pharmacology, physiology, and mechanisms of incretin hormone action. Cell Metab. 2013.
DIABÈTE
Les hormones incrétines sont des hormones intestinales qui amplifient la sécrétion d'insuline induite par les nutriments en réponse à la prise de repas. Les peptides incrétines, principalement le Glucagon-like Peptide-1 (GLP-1) et le Gastric inhibitory polypeptide (GIP), régulent la sécrétion des hormones des îlots de Langerhans, les concentrations de glucose, le métabolisme des lipides, la motilité intestinale, l'appétit et le poids corporel, ainsi que la fonction immunitaire, fournissant une base scientifique pour l'utilisation de thérapies basées sur les incrétines dans le traitement du diabète de type 2 1. Les agonistes des récepteurs du peptide-1 de type glucagon (GLP-1 RA) sont des options intéressantes pour le traitement du DT2 car ils réduisent efficacement la glycémie et le poids tout en présentant un faible risque d'hypoglycémie. Certains AR GLP-1 ont également des effets bénéfiques documentés sur le système cardiovasculaire, la maladie rénale chronique et la stéatose hépatique non alcoolique.
1 Pharmacology, physiology, and mechanisms of incretin hormone action. Cell Metab. 2013.
Selon l'OMS, 287 000 femmes meurent chaque année pendant et après la grossesse et l'accouchement. La plupart de ces décès (95 %) surviennent dans des environnements à faibles ressources, et la plupart d'entre eux auraient pu être évités. Cela inclut environ 70 000 femmes qui meurent chaque année d'une hémorragie post-partum (HPP), dont 95 % dans les pays à faibles ressources.
La santé maternelle englobe le bien-être des femmes pendant la grossesse, l'accouchement et la période postnatale. Malgré les progrès considérables réalisés au cours des dernières décennies, le bilan reste inacceptable : en 2020, environ 287 000 femmes perdront la vie pendant et après leur grossesse, en raison de causes directes courantes telles que les saignements excessifs, les infections, l'hypertension artérielle, les avortements pratiqués dans de mauvaises conditions de sécurité et l'obstruction de l'accouchement. En outre, des facteurs indirects tels que l'anémie, le paludisme et les maladies cardiaques peuvent contribuer à l'aggravation de la situation1,2.
Hémorragie post-partum
Les saignements excessifs après l'accouchement, connus sous le nom d'hémorragie du post-partum (HPP), sont le principal facteur de mortalité maternelle à l'échelle mondiale. Chaque année, environ 14 millions de femmes souffrent d'HPP3.
1 Organisation mondiale de la santé - Fiche d'information sur la santé maternelle (dernière consultation le 25 septembre 2023).
2 Organisation mondiale de la santé - Fiche d'information sur la mortalité maternelle (dernière consultation le 25 sept. 2023).
3 Organisation mondiale de la santé - Feuille de route pour lutter contre l'hémorragie du post-partum entre 2023 et 2030.
Le carbétocine a été approuvé par la FDA en 1997 et sa formulation thermostable a été ajoutée à la liste principale de la LME en 2019 pour la prévention de l'hémorragie post-partum sur la base d'effets similaires à ceux de l'ocytocine en termes d'efficacité et de sécurité. Contrairement à l'ocytocine, le carbétocine thermostable ne nécessite pas de transport dans la chaîne du froid ni de stockage réfrigéré, ce qui présente des avantages et réduit le risque de perte de qualité par rapport à l'ocytocine dans les PRFM. La carbétocine thermostable est prometteuse pour les environnements à faibles ressources.
Dans la plupart des domaines pathologiques dans lesquels MPP a travaillé, l'accès aux médicaments pour les enfants est inférieur à celui des adultes et, dans de nombreux cas, des médicaments importants ne sont pas disponibles dans des formulations qui peuvent être prises facilement par les jeunes enfants.
Depuis sa création, le MPP a donné la priorité à la collaboration avec les fabricants pour mettre sur le marché les formulations pédiatriques nécessaires, notamment en accélérant leur développement et en facilitant leur adoption. Cette contribution s'est faite de plus en plus en partenariat avec d'autres acteurs clés du secteur pédiatrique.
À l'avenir, MPP continuera à mettre l'accent sur la satisfaction des besoins des enfants dans tous les domaines pathologiques dans lesquels il opère. Sa contribution en pédiatrie sera alignée sur le réseau Global Accelerator for Paediatric Formulations (GAP-f), un réseau de l'OMS dont MPP est un membre fondateur, afin de garantir que les formulations pédiatriques optimales les plus nécessaires soient priorisées, développées et mises à la disposition des enfants de manière accélérée.
Drépanocytose
En 2019, 605 000 personnes sont nées avec la drépanocytose, tandis qu'un total de 5,69 millions de personnes vivaient avec cette maladie1. C'est notamment en Afrique subsaharienne que la prévalence de la drépanocytose est la plus élevée, avec environ 80 % des cas dans cette région2. Tragiquement, le taux de mortalité des enfants de moins de 5 ans dans cette région varie de 50 % à 80 %3.
Virus respiratoire syncytial
Le virus respiratoire syncytial (VRS) est un virus qui provoque une infection respiratoire aiguë chez les individus de toutes les tranches d'âge. Si la plupart des nourrissons et des jeunes enfants présentent des symptômes bénins, semblables à ceux d'un rhume, certains d'entre eux, en particulier lors de leur première infection, développent une maladie des voies respiratoires inférieures telle que la pneumonie et la bronchiolite (gonflement des petites voies respiratoires dans les poumons), qui conduit souvent à une visite aux urgences ou au cabinet d'un médecin. Les enfants prématurés et ceux qui souffrent d'une maladie pulmonaire chronique de la prématurité ou d'une cardiopathie congénitale importante sont les plus exposés au risque de maladie grave due au VRS4. On estime que le VRS a causé 101 400 décès chez les enfants de moins de 5 ans en 20195.
Mucoviscidose
La mucoviscidose est une maladie rare, progressive et potentiellement mortelle, causée par des mutations du gène CFTR (régulateur de la conductance transmembranaire de la mucoviscidose), qui entraîne la formation d'un mucus épais qui s'accumule dans les poumons, le tube digestif et d'autres parties du corps. Cette maladie entraîne de graves problèmes respiratoires et digestifs, ainsi que d'autres complications telles que des infections et le diabète. Il n'existe pas de traitement curatif et les personnes atteintes de mucoviscidose reçoivent des traitements quotidiens en fonction de la gravité de leurs symptômes6. Il n'existe pas d'estimation mondiale du nombre de décès annuels dus à la mucoviscidose et de l'espérance de vie correspondante, mais on estime généralement qu'en l'absence de modulateurs du CFTR, l'espérance de vie médiane des personnes atteintes de mucoviscidose serait d'environ 24,5 ans (contre 46 ans en présence du CFTR)7.
1 Institute for Health Metrics and Evaluation - Étude sur la charge mondiale de morbidité 2019.
2 La drépanocytose. Lancet. 2010.
3 Drépanocytose et hypertension pulmonaire en Afrique : une perspective globale et une revue de l'épidémiologie, de la physiopathologie et de la prise en charge. Am J Hematol. 2008.
4 Organisation mondiale de la santé - Virus respiratoire syncytial (VRS) (dernier accès : 25 sept. 2023).
5 Estimations de la charge de morbidité mondiale, régionale et nationale des infections aiguës des voies respiratoires inférieures dues au virus respiratoire syncytial chez les enfants de moins de 5 ans en 2019 : une analyse systématique. The Lancet. 2022.
6 American Lung Association - Cystic Firbrosis (dernier accès le 25 septembre 2023)
7 Taux mondiaux de diagnostic et de traitement efficace de la mucoviscidose. Journal of cystic fibrosis. 2022.
L'association des substances actives elexacaftor, ivacaftor et tezacaftor est la première trithérapie disponible pour traiter les patients présentant la mutation la plus courante de la mucoviscidose. Elle a été approuvée pour les patients de 12 ans et plus atteints de mucoviscidose et présentant au moins une mutation F508del dans le gène du régulateur de la conductance transmembranaire de la mucoviscidose (CFTR), ce qui représente, selon les estimations, 90 % de la population atteinte de mucoviscidose.
DRÉPANOCYTOSE
Voxelotor est un modulateur de l'affinité pour l'oxygène de l'hémoglobine approuvé par la FDA en 2019 pour le traitement de la drépanocytose. Voxelotor a un mode d'action différent de celui des thérapies conventionnelles de référence, ce qui le rend pertinent comme traitement complémentaire ou en cas d'intolérance.
VIRUS RESPIRATOIRE SYNCYTIAL
Le nirsevimab est un anticorps monoclonal actif contre le virus respiratoire syncytial (VRS). Les anticorps monoclonaux sont des protéines fabriquées en laboratoire qui imitent la capacité du système immunitaire à combattre les agents pathogènes dangereux tels que les virus. Une dose de nirsevimab administrée aux nourrissons en une seule injection intramusculaire avant ou pendant la saison du VRS peut fournir une protection pendant la saison du VRS. Les nourrissons présentent l'incidence la plus élevée de maladies graves, avec un pic à l'âge de 1 à 3 mois.
Le travail initial de MPP a commencé par les maladies infectieuses, notamment le VIH, l’hépatite virale et la tuberculose (TB), et a obtenu des licences qui ont eu un impact important sur la santé publique. En 2018, le mandat de MPP a été élargi pour cibler les médicaments brevetés inclus dans la liste modèle des médicaments essentiels de l’OMS ou susceptibles d’y être inclus à l’avenir, ce qui englobe toute une série de maladies, notamment les cancers, le diabète et les maladies cardiovasculaires, et explore d’autres domaines d’intervention, le cas échéant. En outre, MPP travaille sur les interventions COVID-19 depuis 2020. La nouvelle stratégie du MPP pour la période 2023-2025 adopte une approche agnostique des maladies, selon laquelle les médicaments brevetés pour lesquels une intervention du MPP pourrait potentiellement faire une différence en matière de santé publique pourraient être considérés comme prioritaires, quel que soit le domaine de santé.
Le travail du MPP a commencé avec les petites molécules et, après avoir mené une étude de faisabilité sur l’élargissement de l’accès aux produits biothérapeutiques en 2022, il a étendu son mandat aux produits biologiques. En outre, compte tenu de leur impact potentiel révolutionnaire, les technologies à longue durée d’action et les formulations conçues pour prolonger l’exposition aux médicaments sont considérées comme prioritaires depuis 2021, de même que toute nouvelle technologie médicale pertinente pour laquelle une intervention du MPP pourrait avoir un impact positif sur la santé publique.
Conformément à la nouvelle stratégie du MPP, les produits candidats à des stades de développement plus précoces sont de plus en plus souvent considérés comme prioritaires. Par conséquent, le MPP peut envisager de donner la priorité à des candidats à n’importe quel stade de développement, de la phase préclinique à la mise sur le marché.
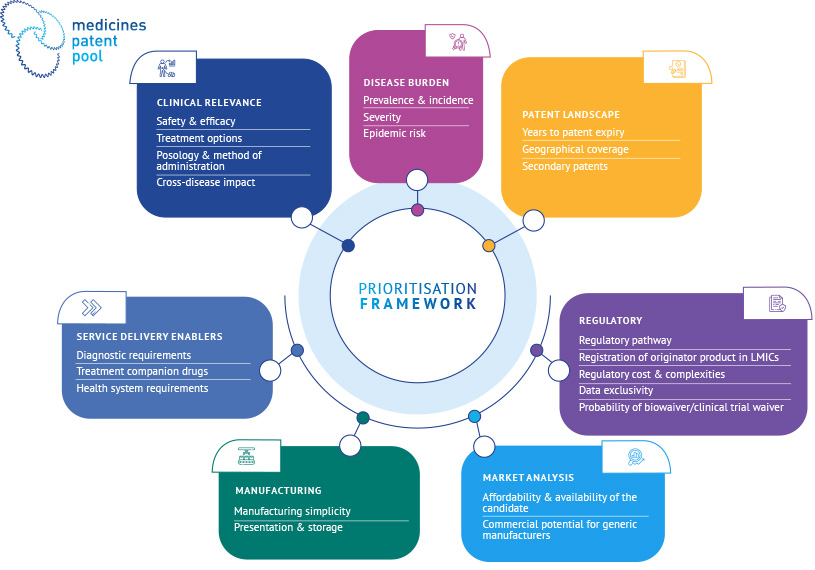
Le cadre de hiérarchisation du MPP a été conçu pour répondre aux trois questions suivantes, en tant que principes directeurs. En répondant à ces questions, le MPP recueille des informations sur les dimensions de santé publique et d’accès des produits évalués, ainsi que des informations permettant d’évaluer l’impact potentiel d’une intervention du MPP.
1. Le produit répond-il à un besoin de santé publique ?
Cette question est évaluée par le biais du premier pilier du cadre : le pilier de la santé publique, qui évalue le fardeau de l’état de santé ainsi que les avantages du produit candidat par rapport aux alternatives de soins existantes pour cet état de santé.
2. Existe-t-il des obstacles à l’accès (anticipés ou existants) au produit dans les PRFM ?
Cette question est évaluée dans le cadre du deuxième pilier : le pilier de l’accès. Il comprend des considérations d’accès sur lesquelles MPP intervient directement (par exemple, la propriété intellectuelle), ainsi que des considérations d’accès supplémentaires qui peuvent être importantes dans la cascade de traitement (par exemple, l’accès aux diagnostics).
3. L’intervention du MPP apporterait-elle une amélioration par rapport au statu quo ?
Cette question s’appuie à la fois sur les piliers de la santé publique et de l’accès, et garantit que les produits candidats sont classés par ordre de priorité là où une intervention du MPP pourrait avoir l’impact le plus significatif.
Télécharger
Les médicaments évalués sont classés en deux catégories :
La liste des priorités du MPP comprend les médicaments brevetés pour lesquels un accès élargi pourrait apporter des avantages significatifs en matière de santé par rapport aux normes de soins, et pour lesquels l’octroi volontaire de licences par le biais du MPP aurait un impact significatif sur la santé publique.
La liste de surveillance comprend des produits approuvés par les autorités réglementaires strictes (SRA) et des produits expérimentaux pour lesquels les données justificatives manquent encore et/ou des défis clés doivent encore être relevés avant d’obtenir des éclaircissements sur l’importance d’une intervention du MPP. Les produits figurant sur la liste de surveillance font l’objet d’un suivi attentif ; toutefois, l’engagement actif du MPP auprès des détenteurs de brevets n’est pas déclenché par l’inclusion sur cette liste.